Для обозначения вида атомов с определенным зарядом ядра и массовым числом используют термин – нуклид. Ядро (латинское «nucleus» — «ядро»). – нуклид.
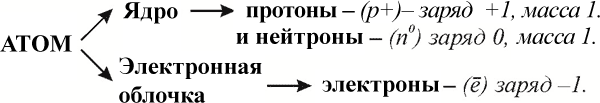
|
Протон — это положительно заряженная частица с зарядом +1 и с массой, равной массе атома гидрогена, т.е. 1. Таким образом, протоны представляют собой ядра атомов гидрогена. Число протонов совпадает с порядковым номером элемента в периодической таблице элементов. Д.И. Менделеевым. Поэтому порядковый номер элемента еще называют протонным числом. Важнейшей характеристикой атома является количество протонов в ядре (заряд ядра). |
Нейтрон – это частица с массой 1, но лишенная заряда. Нейтроны – электронейтральные частицы, поэтому они не влияют на заряд ядра, а только на его массу. |
|
Каждая из этих частиц имеет определенную массу. Массы протонов и нейтронов почти одинаковы (mпротона= 1.0073, mнейтрона= 1.0086 в а.е.м.). Элементарные частицы ядра удерживаются так называемыми ядерными силами. |
|
Электронная оболочка
|
Вокруг ядра вращаются совсем маленькие частицы – электроны. Электроны размещаются на разных расстояниях от ядра формируя электронные слои или уровни, число которых совпадает с номером периода и образуют отрицательно заряженную электронную оболочку атома. Электроны – это отрицательно заряженные частицы с зарядом –1 (в единицах измерения заряда элементарных частиц). Масса электрона в 1840 раз меньше массы протона (me–=0,00055). Электроны удерживаются в атоме за счет притяжения к положительно заряженному ядру, однако электроны не падают на ядро, потому что они двигаются со значительной скоростью в пределах стационарных орбит. Масса электрона очень маленькая, поэтому можно считать, что вся масса атома сконцентрирована в ядре. Однако радиус ядра атома в десятки раз меньше радиуса атома с электронами, размещенными в электронном слое. Для представления о соотношении величин атомных структур: если атом увеличить до размеров стадиона, то ядро будет величиной с вишневую косточку. |
Число протонов в атоме равно числу электронов, поэтому атом в целом электронейтрален.
Массы протона и нейтрона примерно одинаковы. В ядре сосредоточена почти вся масса атома. Количество протонов N(p+) в ядре и количество электронов N(ē) равно порядковому номеру элемента (Z):

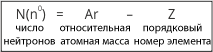
Поскольку масса протона и масса нейтрона равна 1, а число протонов соответствует порядковому номеру элемента, то зная относительную массу атома легко рассчитать число нейтронов:

Рассмотрим устройство атома Натрия.
|
Порядковый номер этого химического элемента – 11. Значит, в ядре атома имеется 11 протонов, а вокруг ядра движется 11 электронов. Относительная масса протона равна 1, значит масса всех протонов – 11. Пренебрегая массой 11электронов, найдем число нейтронов, зная, что относительная атомная масса натрия равна примерно 23: N(n0) =Ar(Na) – Z(Na) = 2 = 12. |
Электроны удерживаются в атоме за счет притяжения к положительно заряженному ядру, однако электроны не падают на ядро, потому что они двигаются со значительной скоростью в пределах стационарных орбит.
Ядра с большим числом протонов (более 83) нестабильны, для них характерен радиоактивный распад. Неустойчивость крупных ядер является причиной того, что в природе нет элементов с порядковым номером больше 92. Атомы этих элементов добывают в лабораторных условиях.


















