Во время химических реакций ядро атома не изменяется. Изменения претерпевают электронные оболочки атомов, особенностями строения которых объясняются свойства химических элементов.
Кроме вращения вокруг ядра, электрон имеет еще свое направление движения – спин. Это движение электрона вокруг своей оси. Если два электрона имеют одинаковые направления вращения, то говорят, что это электроны с параллельными спинами, а если направления вращения у них противоположны (один электрон вращается вокруг своей оси по часовой стрелке, а другой – против часовой стрелки), то это – электроны с противоположными (антипараллельными) спинами. Два электрона с противоположными спинами создают вокруг себя магнитное поле с противоположно направленными силовыми линиями, что обеспечивает взаимное притяжение электронов. На одной орбитали могут находиться всего два электрона с противоположными спинами. Схематически атомную орбиталь обозначают квадратиком, а электроны стрелочками в двух противоположных направлениях: ![]() .
.
Характеристика орбиталей
Электронное облако может иметь разную плотность, размер и форму. Чем сильнее притягивается электрон к ядру, тем его облако плотнее и меньше по размеру. Электронное облако может иметь несколько форм. Электрон двигаясь вокруг ядра, может образовывать облако шаровидной формы. Орбиталь, имеющий форму шара называют s-орбиталью, а электрон, образующий такую форму орбитали – s-электроном.
Орбитали могут иметь форму гантели (объемной восьмерки) или более сложную. Орбитали, имеющие форму гантели обозначают буквой p, а электроны, образующие такую орбиталь называют p-электронами. Эти электроны размещаются в пространстве вдоль трех взаимно перпендикулярных осей координат.
Строение электронных оболочек атомов
На каждом энергетическом уровне двигаются электроны с одинаковой или очень близкой энергией. Первому уровню принадлежат электроны, которые находятся ближе всего к ядру и поэтому имеют наименьшую энергию. Электроны второго уровня характеризуются более высокой энергией, третьего — еще более высокой.
Энергетические уровни обозначают буквами K, L, M, N … или цифрами 1, 2, 3, 4… и условно обозначают их скобками ![]() (как частью от круга) при записи размещения электронов на энергетических уровнях.
(как частью от круга) при записи размещения электронов на энергетических уровнях.
На каждом энергетическом уровне двигается ограниченное число электронов. Их максимальное число на энергетическом уровне определяется по формуле:
N = 2n2, где n – номер уровня.
I уровень 2 × 12 = 2. III уровень 2 × 32 = 18.
II уровень 2 × 22 = 8. IV уровень 2 × 42 = 32.
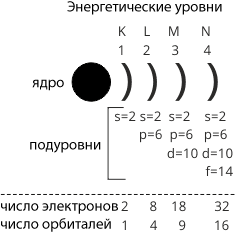
Схема 1. Расположение электронов на энергетических уровнях и подуровнях.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны (орбиталь условно обозначают квадратиком, а электроны – стрелками в противоположных направлениях).
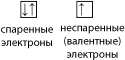 |
Если внешний электронный слой атома имеет максимальное число электронов, которое может вместить, то такой слой называют завершенным. Если во внешнем электронном слое атома содержится меньше электронов, чем может вместить, то этот слой называют незавершенным. |
На последнем энергетическом уровне какого-либо атома не может быть больше 8 электронов.
Электронное строение атома Сульфура
Электронная схема – распределение электронов в атоме на энергетических уровнях.
Для написания электронной схемы необходимо:
|
1. |
По порядковому номеру элемента определяем число протонов в ядре, и число электронов, указываем символ элемента. |
|
|
2. |
Номер периода указывает на число энергетических уровней (пишем число скобок). |
|
|
3. |
Номер группы элемента указывает на число электронов на внешнем энергетическом уровне. |
|
|
4. |
Пишем максимальное число электронов, на первом энергетическом уровне (2), а второй рассчитываем по разнице: 16 – 6 – 2 = 8.(Если уровней больше, то поступаем так: пишем число электронов по номеру группы под последним уровнем, под первыми уровнями — максимальное их количество для этих уровней, а под предпоследним – остаток). |
|
|
1. |
16 электронов в атоме Сульфур находятся на трех энергетических уровнях. На первом уровне (1) движется два s-электрона (число электронов пишется вверху справа). |
1s2 |
|
2. |
На втором энергетическом уровне (2) двигаются два s-электрона и шесть p-электронов (номер уровня пишется для каждого подуровня). |
2s2 2p6 |
|
3. |
На третьем энергетическом уровне (3) двигаются два s-электрона и четыре p-электрона. |
3s2 3p4 |
|
4. |
Суммарная электронная формула будет выглядеть |
1s22s22p63s23p4 |
Орбитали заполняют следующим образом:
|
1. |
Первый энергетический уровень имеет только один s-подуровень, на котором находятся два электрона с противоположными спинами. |
|
|
2. |
Второй энергетический уровень имеет два подуровня: на s-подуровне находится 2 электрона и на p-подуровне – 6 (на трёх орбиталях). |
|
|
3. |
Третий энергетический уровень имеет три подуровня: на s-подуровне находится 2 электрона, на p-подуровне – 4 (на трёх орбиталях), а d-подуровень (пять орбиталей) в Сульфуре не заполнен. |
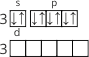 |
В таком, невозбужденном состоянии атом Сульфура имеет два неспаренных электрона – то есть проявляет валентность II.
На третьем d-подуровне есть свободные орбитали, поэтому в возбужденном состоянии электроны с 3p-подуровня и 3s-подуровня могут «перепрыгивать» на 3d-подуровень, занимая свободные орбитали. Валентность атома при этом меняется на IV или VI.
Размещая электроны по электронным (квантовым) ячейкам, можно выявить число неспаренных электронов в атоме и возможную валентность элемента.
Под действием внешней энергии, электрон может «перепрыгнуть» с нижнего уровня на более высокий уровень в пределах одного энергетического уровня. Такое состояние атома называют возбуждением.
В пределах одного периода у элементов главных подгрупп постепенно увеличивается число электронов на последнем, а у элементов побочных подгрупп – на предпоследнем энергетическом уровне.
Чтобы рассчитать число неспаренных электронов у элементов IV-VII групп главных подгрупп, необходимо из числа 8 вычесть номер группы.


















