Ионные реакции
При взаимодействии электролитов соединяется только противоположно заряженные ионы. Если при этом образуется новое вещество в виде осадка, газа, слабого электролита, то такие реакции можно считать необратимыми, то есть идущими до конца. Такие реакции называются ионными и записывают их ионными уравнениями.
Реакции в водных растворах электролитов являются реакциями между ионами и называются ионными реакциями.
При составлении реакций ионного обмена следует помнить:
Чтобы сделать вывод о протекании реакций ионного обмена до конца надо использовать данные таблицы растворимости солей, оснований и кислот в воде. Рассмотрим реакцию образования нерастворимого соединения аргентум хлорида из натрий хлорида и аргентум нитрата.
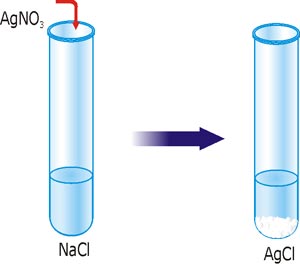
Рис. 26. Реакция ионного обмена с образованием осадка AgCl.
Составляем молекулярное уравнение реакции:
NaCl + AgNO3 = AgCl↓ + NaNO3.
По таблице растворимости видим, что соединения NaCl, AgNO3 и NaNO3 растворимы, поэтому в водном растворе они находятся в виде ионов. AgCl – нерастворимое, формула этого вещества остается в молекулярном виде, за ней указываем стрелочку вниз (↓).
Записываем полное ионное уравнение: Na+ + Cl– + Ag+ + NO3– = AgCl↓ + Na+ + NO3–.
Отмечаем ионы, которые в процессе реакции не претерпели изменений и изымаем их из правой и левой части уравнения (сокращаем). Образование осадка сводится к взаимодействию ионов Ag+ и Cl–, так как образовалось нерастворимое соединение AgCl. Все остальные ионы участия в реакции не приняли. Записываем сокращенное ионное уравнение: Ag+ + Cl– = AgCl↓.
Сокращенное ионное уравнение показывает между какими ионами фактически произошла реакция, которая привела к связыванию ионов. В этой реакции вам были известны исходные вещества для получения указанного соединения. Но на практике часто приходится самому подбирать исходные вещества.
Например, какими веществами вы можете воспользоваться, чтобы получить нерастворимое соединение BaSO4. Для образования BaSO4 приняли участие ионы Ba2+ + SO42– = BaSO4. Понятно, что исходные вещества должны быть растворимы. Находим в таблице растворимости растворимые соединения бария. Это могут быть: Ba(OH)2, Ba(NO3)2, BaCl2, BaI2. Теперь находим в таблице растворимости растворимые соединения с анионом SO42–. Это могут быть: H2SO4, Li2SO4, K2SO4, MgSO4, ZnSO4 и другие. Подбираем два произвольных вещества из этих групп, например BaCl2 і Na2SO4.
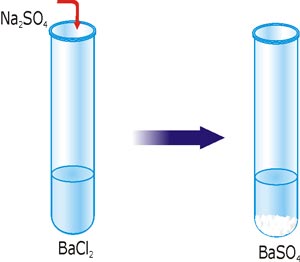
Рис. 28. Реакция ионного обмена с образованием осадка BaSO4
Ионные реакции – реакции между ионами.
Составляем молекулярное уравнение реакции:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Записываем полное ионное уравнение: Ba2+ + 2Cl– + 2Na+ + SO42– = BaSO4 + 2Na+ + 2Cl–.
Изъяв из правой и левой части уравнения те ионы, которые не изменили свой состав в течение реакции, запишем ионы, которые практически провзаимодействовали между собой: Ba2+ + SO42– = BaSO4 (сокращенное ионное уравнение).
Это нерастворимое соединение можно получить другим способом. Анион SO42– ввходит в состав сульфатной кислоты. Кислоты взаимодействуют с оксидами металлических элементов, гидроксидами и солями с образованием соли. Для примера используем барий оксид.
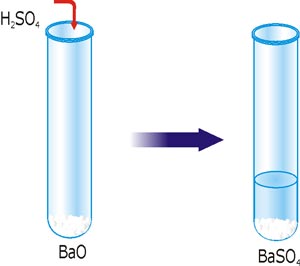
Рис. 28. Реакция ионного обмена с образованием осадка BaSO4.
Записываем молекулярное уравнение реакции, и подчеркиваем нерастворимые или малодиссоциированные соединения: BaO + H2SO4 = BaSO4↓ + H2O.
Полное ионное уравнение будет иметь вид: BaO + 2H+ + SO42– = BaSO4 + H2O.
В данном случае произошло связывание ионов H+ и SO42– с оксидом бария, с образованием нерастворимого BaSO4 и малодиссоциированного соединения H2O.
Если при взаимодействии двух сильных электролитов образуются два сильных электролита, то такие реакции являются обратимыми, например: K2SO4 (растворимый) + CuCI2 (растворимый) ⇄ 2KCI (растворимый) + CuSO4 (растворимый):
2K+ + SO42– + Cu2+ + 2Cl– ⇄ 2K+ + 2Cl– + Cu2+ + SO42–.
Поскольку не происходит связывания ионов, то практически реакция не происходит.
Составляя уравнения реакций ионного обмена, при которых образуются газообразные вещества, следует учесть, что анионы CO32–, SO32–, S2– способны реагировать с кислотами, с образованием соответствующего газа:
SO32– + 2H+ → H2O + SO2↑;
S2– + 2H+ → H2S↑;
CO32– + 2H+ → H2O + CO2↑.
Лабораторный опыт 2. Реакции, в результате которых образуется осадок
В одну пробирку влейте 3-4 мл раствора купрума (II) сульфата, во вторую – феррум (III) хлорида, в третью – барий хлорида. В первые две пробирки добавьте немного раствора натрий гидроксида, а в третью – сульфатной кислоты.
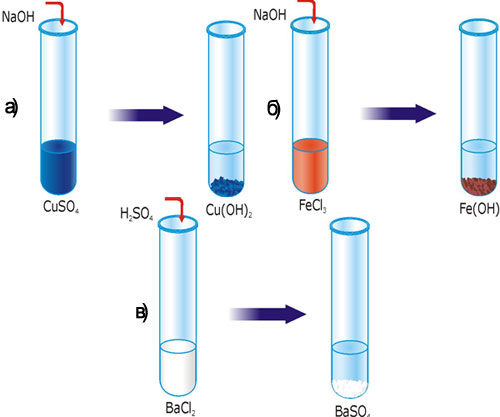
Рис. 29. Реакция ионного обмена с образованием осадка: а)Cu(OH)2; б) Fe(OH)3; в) BaSO4.
Задание: составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде. Объясните, почему образовались осадки? Какие вещества выпали в осадок? Растворы каких еще веществ можно влить в пробирки, чтобы выпал осадок?
Лабораторный опыт 3. Реакции, в результате которых выделяется газ
В пробирку влейте 2-3 мл раствора натрий карбоната и добавьте несколько капель хлоридной кислоты.
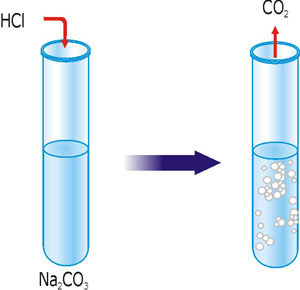
Рис. 30. Реакция ионного обмена с образованием газа.
Задание: составьте уравнение реакции, которая произошла в молекулярном, полном и сокращенном ионном виде. При действии каких кислот на этот раствор можно получить аналогичные результаты?
Лабораторный опыт 4. Реакции, в результате которых образуются малодиссоциированные вещества
В одну пробирку влейте 2-3 мл раствора натрий гидроксида и добавьте 1-2 капли фенолфталеина. Раствор приобретет малиновое окрашивание. Затем влейте раствор хлоридной или сульфатной кислоты до обесцвечивания.
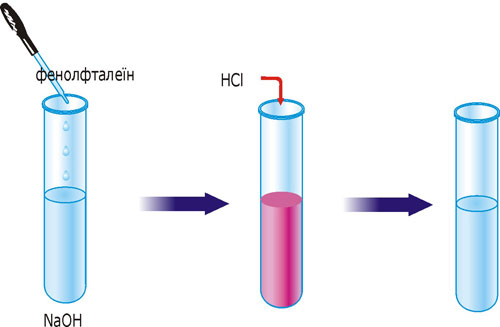
Рис. 31. Реакция ионного обмена с образованием малодиссоциированного соединения воды.
Задание: составьте уравнение произошедшей реакции в молекулярном, полном и сокращенном ионном виде. Объясните, почему раствор сначала приобрел цвет, а затем обесцветился. Между какими ионами практически произошла реакция? Для обобщения знаний можно воспользоваться таблицей.
Таблица 1. Молекулярные, полные ионные и сокращенные ионные уравнения реакций, условия протекания ионных реакций
|
Реагирующие вещества |
Уравнения реакций |
||
|
в молекулярном виде |
полные ионные |
сокращённые ионные |
|
|
Хлорид натрия и нитрат (II) плюмбума |
Образуется осадок: |
2Na+ + 2Cl– + Pb2+ + 2NO3– → |
Pb2+ + 2Cl– → PbCl2↓ |
|
Натрий карбонат и хлоридная кислота |
Образуется газ: Na2CO3 + 2HCl → |
2Na+ + CO32– + 2H+ + 2Cl– → |
CO32- + 2H+ → H2O +CO2↑ |
|
Калий гидроксид и нитратная кислота |
Образуется малодиссоциирующее вещество: KOH+ HNO3 → |
K+ + OH– + H+ + NO3– → |
H+ + OH– → H2O |
|
Магний хлорид и натрий сульфат |
Признаки реакции не наблюдаются: MgCl2 + Na2SO4 ⇄ |
Mg2+ + 2Cl– + 2Na+ + SO42– ⇄ |
|
|
Реакция практически не происходит, так как не происходит связывание ионов. |
|||
Свойства ионов
Вы уже знаете, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, другие имеют определенный цвет.
|
Цвет некоторых ионов: |
|
|
Cu2+ – голубой Fe2+ – светло-зелёный Fe3+ – жёлтый Nі2+ – зелёний Cr2+ – голубой |
MnO4– – фиолетовый Cr2O72– – оранжевый Co2+ – розовый CrO2– – зелёный Mn2+ – розовый |
Ионы отличаются от атомов строением и свойствами.
Для каждого из них характерны специфические (качественные) химические свойства (см. приложение, таблица).
Например, для того чтобы выявить наличие иона Cu2+ в растворе необходимо добавить раствор, в котором содержатся ионы OH– или S2–. Если к раствору CuCl2 добавить раствор щелочи, то образуется нерастворимое соединение Cu(OH)2 синего цвета:
Cu2+ + 2ОH– = Cu(OH)2↓
Cu2+ + S2– = CuS↓ чёрный осадок.
Используя качественные реакции можно доказать наличие в растворе того или иного иона.
Итог:
- Реакции обмена между ионами называются реакциями ионного обмена.
- Реакции ионного обмена идут до конца, если:
- образуется осадок (нерастворимое соединение);
- образуется газообразное соединение;
- образуется малодиссоциированное соединение (например, вода).
При этом происходит связывание ионов в молекулы.
- Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не происходит до конца.
- Карбонатная и сульфитная кислоты как продукты реакций не существуют, так как разлагаются с выделением газов:
![]() ,
, ![]() .
.
?
- Почему реакции обмена называют реакциями ионного обмена?
- В каком случае реакции ионного обмена реально происходят?
Практическая работа 2. Реакции ионного обмена в растворах электролитов
Для работы необходимы:
реактивы: растворы CuSO4, FeCI2, AI2(SO4)3, NaOH, BaCI2, Na2CO3, Na2SO3, HCI и фенолфталеин.
оборудование: штатив с пробирками, бюретка, газоотводная трубка.
Порядок выполнения работы:
Опыт 1. Реакции обмена, в результате которых образуется осадок:
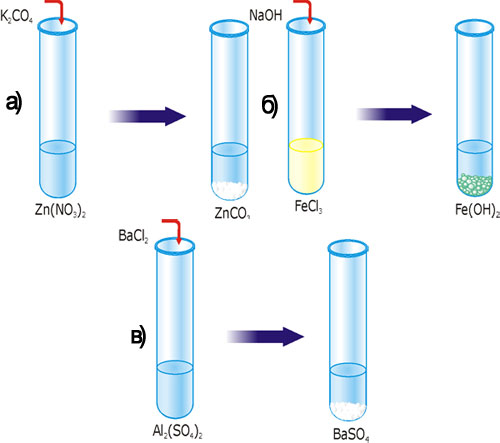
Рис. 32. Реакция ионного обмена с образованием осадка: А – ZnCO3; Б – Fe(OH)2; В – BaSO4.
В одну пробирку влейте 1-2 мл раствора цинк нитрата, во вторую – столько же раствора феррум (II) хлорида, а в третью – алюминий сульфата. В первую пробирку добавьте немного раствора калий карбоната, во вторую – раствора натрий гидроксида, а в третью – раствора барий хлорида.
Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах. Объясните, почему образовались осадки?
Опыт 2. Реакции обмена, в результате которых выделяется газ:
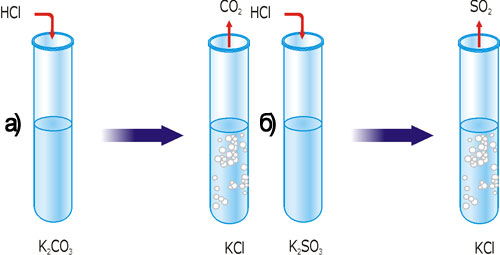
Рис. 33. Реакция ионного обмена с образованием газа: А – CO2; Б – SO2.
В одну пробирку налейте 2 мл раствора калий карбоната, а в другую — такой же объем раствора калий сульфита. В обе пробирки долейте одинаковые объемы раствора хлоридной кислоты. Что наблюдается? Почему? Обратите внимание на запах газов. Что выделяется? Вспомните правило по выявлению запаха неизвестного газа. Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах.
Опыт 3. Реакции обмена, в результате которых образуется малодиссоциированное вещество.
В пробирку налейте 1 мл раствора калий гидроксида и добавьте 1-2 капли фенолфталеина. Что наблюдается? Доливайте каплями раствор сульфатной кислоты до обесцвечивания жидкости. Почему происходит обесцвечивание? Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах.
Практическая работа 3. Решение экспериментальных задач по теме «Электролитическая диссоциация»
Для работы необходимы:
реактивы: Na2S, HCI, H2SO4, Na2SO3, BaCI2, CuSO4, NaOH, K2CO3, AgNO3, Fe, Zn, CaO, H2O и фенолфталеин.
оборудование и химическая посуда: пробирки, спиртовка, спички.
Опыт 1. Получите реакцией обмена с помощью имеющихся на столе реактивов следующие вещества:
а) H2S, BaSO4; б) H2SO3, Cu(OH)2; в) H2CO3, AgCl.
Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах, объясните их.
Опыт 2. проведите реакции между такими веществами:
а) раствором купрум (II) сульфата и железом;
б) раствором сульфатной кислоты и цинком;
в) раствором купрум (II) сульфата и цинком.
Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах, покажите переход электронов и укажите окислитель и восстановитель.
Опыт 3. Проведите реакции по следующим схемам:
Ba2+ +SO42– → BaSO4;
2H+ + CO32– → H2O + CO2;
2H+ +OH– → H2O.
Складіть рівняння реакцій в молекулярній, повній і скороченій йонній формах. Зазначте реакції кожної з них.
Опыт 4. Практически выполните следующие преобразования:
CaO → Ca(OH)2 → CaCl2 → CaCO3;
CuO → CuCl2 → Cu(OH)2.
Составьте уравнения реакций в молекулярной, полной и сокращенной ионной формах, укажите признаки и условия каждой из них.


















