Вам известно, что при смешивании веществ с водой образуются как однородные системы (характерное свойство растворов), так и неоднородные смеси. Задумывались ли вы над тем, почему одни вещества с водой образуют однородную систему, а другие неоднородную? Чтобы ответить на этот вопрос, нужно выяснить, что происходит в процессе растворения веществ в воде.
При растворении вещества измельчаются, поэтому истинные растворы, а также суспензии и эмульсии относятся к дисперсным системам («диспергирование» означает «измельчение»). Дисперсных систем существует много. Они различаются между собой в зависимости от того, на какие частицы (твердые, жидкие, газообразные) и в какой среде (жидкой, газообразной) они распределены. Так, например, одна из дисперсных систем – дым состоит из смеси газов и измельченных частиц твердого вещества. Туман – дисперсная система, где средой может быть воздух, а диспергированными частицами – мелкие капли жидкости. Пены – дисперсные системы, где средой является жидкость, а диспергированным веществом – газ. Подобную систему могут образовывать смеси разных веществ в разном агрегатном состоянии.

Примеры дисперсных систем: а) дым; б) туман; в) пена
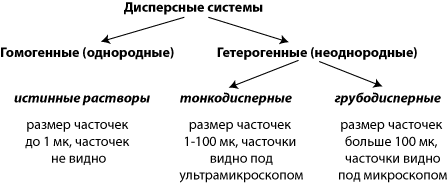
Наиболее распространены в природе дисперсные системы, в которых дисперсной средой является жидкость, а дисперсной фазой – твердое вещество. В зависимости от размера частиц твердого вещества дисперсные системы делятся на грубодисперсные (взвеси и неоднородные смеси с размерами частиц более 1 мк) и на тонкодисперсные (коллоидные) системы. Если частицы распределенного в системе вещества имеют размер молекул или ионов, возникает гомогенная система – раствор.
Дисперсные системы бывают газовые, жидкие и твёрдые. Агрегатные состояния распределенного вещества и среды, а также размер частиц определяют свойства дисперсных систем. Если распределенные частицы по размерам значительно больше, чем молекулы, то дисперсная система в некоторой степени неустойчива. Она постепенно становится неоднородной: распределенное вещество, в зависимости от его удельного веса, поднимается на поверхность или выпадает в осадок. Процесс оседания частиц осуществляется тем быстрее, чем более грубодисперсной является система.
Дисперсные системы, содержащие большие частицы (более 100 мк), называются взвесями (мутные смеси).
После проливного дождя, например, вода в реке мутная из-за возмущенных частиц ила. Вода постепенно очищается в результате оседания твердых частиц.
Частицы большинства взвесей можно наблюдать под микроскопом. В зависимости от агрегатного состояния диспергированного вещества такие системы делятся на суспензии и эмульсии. Дисперсные системы, представляющие собой жидкость, в которой распределены твердые вещества, называются суспензиями (например, смесь воды с глиной). Если в одной жидкости распределены капли другой жидкости, такие системы называются эмульсиями. К примеру, эмульсии образуются при взбалтывании керосина, бензина, масла с водой.

а) молоко (эмульсия); б) смесь воды с кофейным напитком (суспензия)
Существуют также сложные дисперсные системы, к примеру, молоко. Оно содержит растворимый в воде молочный сахар и диспергированный в этом растворимый казеин и жир. Со временем жир поднимается на поверхность в виде сливок, а казеин выделяется в виде творога, когда молоко скисает.
Дисперсные системы, содержащие частицы размерами от 1 до 100 мк. называются коллоидными растворами или золями (клеевидные). Частицы коллоидных растворов можно видеть только с помощью ультрамикроскопов.

Клей – коллоидный раствор
Процесс увеличения размеров коллоидных частиц называется коагуляцией или сворачиванием. В коллоидных растворах коагуляция происходит очень медленно. Если частицы имеют сравнительно большие размеры, они начинают быстро выпадать в осадок, поэтому лекарства, являющиеся суспензиями или эмульсиями, перед приемом рекомендуют взбалтывать.
Если распределенное вещество содержится в дисперсной системе в виде отдельных молекул или ионов, то такая система очень устойчива, она сохраняется достаточно длительный срок и называется истинным (молекулярным или ионным) раствором.
Размер частиц в молекулярных растворах не превышает 1 мк, поэтому истинные растворы называют однородными системами, так как их неоднородность нельзя обнаружить даже с помощью ультрамикроскопа.
Многие газы, жидкости и твердые вещества растворяются в воде. Сахар и поваренная соль легко растворяются в воде; углекислый газ, аммиак и многие другие вещества, соприкасаясь с водой, переходят в раствор и теряют свое предыдущее агрегатное состояние. Растворенное вещество определенным способом можно выделить из раствора. Если выпарить раствор поваренной соли, то соль останется в виде жестких кристаллов.
При растворении веществ в воде (или другом растворителе) образуется однородная (гомогенная) система. Таким образом, раствором называется гомогенная система, состоящая из двух или большего количества компонентов. Растворы могут быть жидкими, жесткими и газообразными. К жидким растворам относятся, например, раствор сахара или поваренной соли в воде, спирта в воде и т.п. К твердым растворам одного металла в другом относятся сплавы: латунь – это сплав меди и цинка, бронза – сплав меди и олова. Газообразным раствором является воздух или вообще любая смесь газов.

Раствор сахара в воде
Приведенное разделение между разными растворами условно, резких границ между ними нет.
Итог:
- Гетерогенность суспензий и золей объясняется тем, что твердое вещество, частицы которого расположены в жидкости, не растворяется в нем.
- В зависимости от растворителя растворы бывают водные и неводные (например, спиртовый раствор иода).
- Слипание коллоидных частиц и их оседание в растворе называют коагуляцией.
- По агрегатному состоянию растворимого вещества растворы делятся на: твердые (например, сплавы), жидкие (например, чай), газообразные (например, смесь газов, воздух).
?
- Какие системы называются дисперсными?
- Что такое эмульсия? Приведите пример.
- Что такое суспензия? Приведите пример.
- Приведите примеры коллоидных и истинных растворов.
Для любознательных
● Коллоидные растворы очень распространены в природе и играют важную роль в физиологических процессах. Так, белок яйца, плазма крови – коллоидные растворы, в которых происходят физиологические процессы.
● Большое значение имеют коллоидные растворы грунта.
● Значительная роль коллоидных растворов в производстве. Разнообразные клеи, лаки, краски – это в основном коллоидные растворы. Такие краски обладают лучшей покровной способностью.
● Вещества в коллоидном состоянии используют в качестве катализаторов.
Экспериментируем
«ХОЛОДЕЦ»
Силикатная кислота существует в виде коллоидного раствора. Это позволяет проделать интересный опыт. К жидкому стеклу добавьте такой же объем дистиллированной воды. При этом образуется 10% раствор соли. Затем добавьте половину объема разбавленной (1:1) хлоридной кислоты. Долив кислоту, быстро перемешайте жидкость. Прозрачный раствор почти сразу становится мутным и превращается в массу, похожую на холодец.


















