Роль воды как растворителя в живой природе
Воду, содержащую большое количество солей кальция и магния, называют жесткой.
Природная вода не бывает чистой, потому что она способна растворять многие вещества. В пресной воде содержится от 0,01 до 0,1% примесей. Морская вода содержит 3,5% растворенных веществ или 80 элементов периодической системы. В 1 кг морской воды находится 35 г разных солей, в наибольшем количестве содержится NaCl.
Общее содержание солей в мировом океане – 5 • 1016 т.
Среди них:
Na+ – 30,6% Ca2+ – 1,2% Cl– – 55,2%
Mg2+ – 3,7% K+ – 1,1% SO42– – 7,7%

Морская вода – это смесь веществ
Много плохо растворимых солей оседает на дно океана. Ежегодно оседает около 2300 млн т солей, главная часть которых – CaCO3. В результате образуются залежи мела и известняка.
Дождевая вода размывает гигантские массивы почвы и уносит его в реки, озера, моря. Озера, богатые растворами солей, являются сырьевыми основами для развития химического производства.
Вода играет важную роль в жизни растений, животных и человека. Она является той средой, в которой проходят химические процессы, обеспечивающие жизнедеятельность организмов. Кроме того, она сама принимает участие в большом количестве биологических реакций. Таких как способность поглощать и выделять во внешнюю среду вещества, сохранение определенной формы клеток, поддержание тургора.
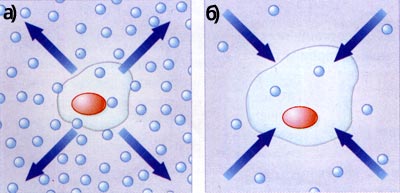
Если концентрация солей в клетке меньше, чем в вокруг клеточном пространстве, вода из клетки выходит (А); если большая — вода в нее входит (Б)
Растения усваивают необходимые для роста и развития вещества в виде растворов.
Лечебные свойства минеральной воды зависят от качественного и количественного состава растворенных в ней веществ.
Взаимодействуя с разными породами, вода образует минералы. Вода оказывает влияние на формирование климата Земли, регулирует состав воздуха, участвует в формировании поверхности Земли. Водные растворы играют важную роль во всех сферах человеческой деятельности.
Строение молекул воды
Как вам известно, в молекуле воды связи между атомами Гидрогена и атомом Оксигена ковалентны полярные. Общие электронные пары смещены к атому Оксигена, поэтому на атомах Гидрогена сосредоточен частично положительный, а на атоме Оксигена – частично отрицательный заряд:
![]()
У атома Гидрогена один неспаренный s-электрон. На внешнем энергетическом уровне атома Оксигена – два неспаренных p-электрона, орбитали которых взаимно перпендикулярны:
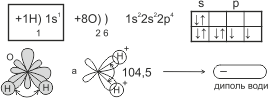
При образовании молекулы воды орбитали p-электронов атома Оксигена перекрываются орбиталью s-электрона атома Гидрогена – вдоль линии координат, образуя угол между связями 104,5°. Положительные и отрицательные заряды расположены неравномерно и находятся на противоположных концах молекулы, поэтому молекула воды имеет два полюса и представляет собой диполь.
Между атомами Оксигена и Гидрогена в молекуле воды возникают прочные связи, поэтому разложить молекулу на атомы можно только с помощью электрического тока. Поскольку атомы Оксигена приобретают частично отрицательный заряд, то они могут взаимодействовать с атомами Гидрогена другой молекулы воды, которые имеют частично положительный заряд. Такая связь называется водородной. Например, это наблюдается в кристалле льда, где каждая молекула воды тетраэдрически соединена водородными связями с четырьмя ближайшими к ней молекулами:
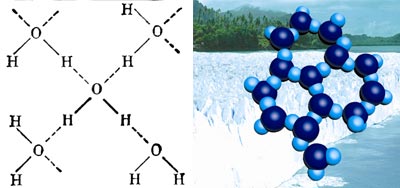
Структура льда.
Светлые кружочки – атомы Гидрогена, темные – атомы Оксигена.
Вода состоит из полярных молекул (диполей).
Поскольку водородная связь длиннее ковалентной связи, структура льда рыхлая. Этим объясняется небольшая густота льда. Прочность водородной связи примерно в 10 раз меньше обычной ковалентной связи. С повышением температуры водородная связь легко разрывается. Этим объясняется переход воды из твердого состояния в жидкое.
Образованием водородных связей между молекулами спирта и воды объясняется хорошая растворимость спирта в воде.
Итог:
- Водные растворы играют важную роль во всех сферах человеческой деятельности.
- В молекуле воды заряды ядер атомов Оксигена и Гидрогена различны и по-разному притягивают орбитальные электроны. В результате молекулярные орбитали смещаются в направлении ядра, имеющего больший положительный заряд и молекула приобретает полярность (превращается в диполь).
- Водородная связь имеет существенное значение во многих химических процессах.
Для любознательных
♦ Вода укрывает около 3/4 всей земной поверхности. 98% от общего количества воды содержится в морях и океанах. В этой воде много солей, поэтому она не пригодна для орошения, питья и для многих других нужд. Запасы пресной воды, необходимой для жизни и технических нужд, составляют всего 2% от общего количества воды. Воду используют для орошения, производства дешевой электрической энергии, в технике как растворитель и реагент в различных химических процессах, для охлаждения и т.д.
♦ Живые организмы содержат большое количество воды. Так, человеческое тело почти на 70 % состоит из воды. Одно взрослое дерево забирает из почвы и испаряет около 50-70 ведер воды в сутки.
♦ Около 20% солнечной энергии, получаемой Землей, тратится на испарение воды. Вода имеет большую теплоемкость. Полученное тепло она отдает в окружающее пространство, что в значительной степени влияет на климат.
?
- Какова роль воды как универсального растворителя в природе?
- Что такое диполь воды?
- Что такое водородная связь?

















