Вещества атомного строения, как правило, практически не растворяются ни в одном растворителе.
Есть вещества, которые смешиваются между собой в любом соотношении, например вода и этиловый спирт. Жидкости – вода, бензен, спирт, расплавленные металлы и другие обладают способностью поглощать, растворять в себе другие жидкости, газы, твердые вещества, образуя однородные системы – растворы. В некоторых случаях растворы образуются при произвольном соотношении веществ (спирт и вода), но обычно растворимость большинства веществ ограничена.
Различают насыщенные, ненасыщенные, пресыщенные, концентрированные и разбавленные растворы.
Твердые вещества, большинство газов и жидких веществ растворяются в воде в определенных соотношениях. Так, при 20ºС в воде массой 100 г может раствориться купрум (II) сульфат, масса которого не превышает 20,7 г. При этом же условии растворяется натрий хлорид массой 36 г. Больше натрий хлорида раствориться в этом растворе не может, тоесть раствор насыщенный.
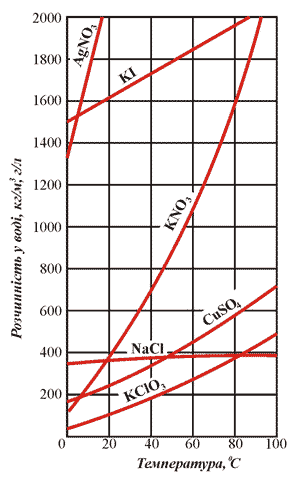
Рис.12. Кривые растворимости некоторых солей
Раствор, в котором вещество больше не растворяется при данной температуре, называется насыщенным.
Раствор, в котором вещество еще может растворяться при данной температуре, называется ненасыщенным.
К примеру, если в воде массой 100 г растворить натрий хлорид массой 20 г при температуре 20ºС, появляется ненасыщенный раствор.
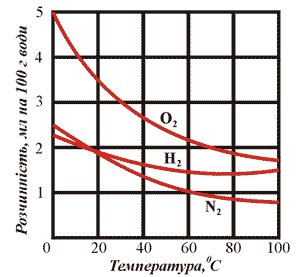
Рис. 13. Кривые растворимости некоторых газов.
Перенасыщенный раствор – это раствор, в котором при данной температуре растворено больше растворимого вещества, которое может растворяться при нормальных условиях.
Как появляется перенасыщенный раствор? При понижении температуры насыщенный раствор может при определенных условиях сохранять указанную концентрацию вещества, т.е. концентрация раствора может оказаться выше, чем в насыщенном растворе при данной температуре (например, фруктовое варенье).
Насыщенные растворы являются стабильными системами, при данной температуре они могут существовать сколь угодно долго без изменения концентрации. Перенасыщенные растворы представляют собой нестабильные системы, то есть достаточно перемешать или бросить в такой раствор крошечный кристаллик вещества, как сразу же начинает выделяться твердая фаза. Этот процесс происходит до тех пор, пока концентрация вещества не достигнет концентрации насыщенного раствора при данной температуре (этим объясняется кристаллизация варенья при длительном хранении).
Разбавленный раствор – это раствор, в котором мало растворенного вещества.
Концентрированный раствор – это раствор, в котором много растворенного вещества. Понятия «концентрированный раствор» и «насыщенный раствор», как «разбавленный раствор» и «ненасыщенный раствор», не тождественны, поскольку основываются на разных признаках. Первые в обоих парах понятий связаны с количественным составом раствора, вторые – с растворимостью вещества.

Рис. 14. Растворимость газов в воде, нагретой больше
при 50ºС уменьшится из-за образования пузырьков.
Часто растворимость твердых и жидких веществ определяют массой вещества, которое может раствориться в 100 г растворителя при определенной температуре, чтобы раствор стал насыщенным. Растворимость газов определяют объемом газа, который может раствориться в 1 л растворителя при определенной температуре. Эта величина называется коэффициентом растворимости.
Например: в 100г воды при температуре 10ºC может раствориться 51,7г Pb(NO3)2.
Процесс растворения вещества зависит от разных факторов. В зависимости от природы растворенного вещества их можно разделить на три группы:
а) хорошо растворимые, если в 100 г воды растворяются более 10 г вещества. Это вещества с ковалентной полярной и ионной связью. К примеру, сахар, соль, спирт, щелочи;
б) малорастворимые, если растворяются менее 1 г вещества. Это вещества с ковалентной неполярной связью. К примеру, кисель, азот, гипс;
в) практически нерастворимые, если в раствор переходит менее 0,01 г вещества. К примеру, масло, керосин.
Вещества ионной природы (соли, щелочи) или вещества, молекулы которых являются полярными (кислоты), хорошо растворяются в полярных растворителях, например в воде. Вещества с неполярными молекулами – азот N2, метан – СН4, масло и многие другие, а также имеющие атомное строение нерастворимы в воде, или растворяются очень мало.
Растворимость большинства твёрдых веществ с повышением температуры увеличивается. Растворимость газов, напротив, уменьшается с повышением температуры. Давление оказывает влияние только на растворимость газов. С уменьшением давления растворимость газа уменьшается.
| Влияние разных факторов на процесс растворения |
→ | природа растворённого вещества | → | хорошо растворимые (в 100 г воды 10 г р.р.) (ионные, к. п.) |
| → | мало растворимые (в 100 г — 0,01-1 г р.в.) (к. н.) | |||
| → | плохо растворимые | |||
| → | практически не растворимые (в 100 г меньше 0,01 г р.в.) | |||
| → | природа растворителя | |||
| → | температура – с повышением температуры увеличивается растворимость жидкостей и твердых веществ, а газов – уменьшается |
|||
| → | давление — с повышением давления увеличивается растворимость газов | |||
| → | концентрация – чем меньше, тем растворимость лучше | |||
| → | перемешивание измельченных веществ | |||

Рис.15. Если открыть бутылку с газировкой, давление в ней уменьшится и начнет выделяться газ.
Для того чтобы ускорить процесс растворения твердых веществ, используют несколько приёмов:
- вещество перед растворением измельчают, чтобы увеличить поверхность контакта с растворителем;
- растворение осуществляют при нагревании;
- смесь вещества и растворителя перемешивают.
Итог:
- По количеству растворенного вещества растворы делят на: насыщенные, ненасыщенные, перенасыщенные, разбавленные и концентрированные.
- Растворимость вещества показывает, какая её масса может раствориться в 100 г растворителя при данной температуре, чтобы раствор стал насыщенным.
- Вода – универсальный растворитель, так как молекула воды полярна и легко разрушает кристаллические решетки растворимых веществ, особенно веществ с ионной или ковалентной полярной связью.
?
- Дайте определение понятию «раствор».
- Что понимают под термином «растворимость»? Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых веществ.
- Какие условия влияют на процесс растворения веществ?
- Может ли быть раствор одновременно разбавленным и насыщенным; концентрированным и ненасыщенным?
- Какую классификацию растворов вы запомнили?
Для любознательных
Совершенно нерастворимых веществ в природе нет. Если в воду опустить серебряную ложку, металл в очень малом количестве переходит в раствор. Такая «серебряная» вода приобретает антимикробные свойства и в отличие от обычной воды может сохраняться длительное время.
Экспериментируем
«Интересные кристаллы»
При охлаждении концентрированного раствора соли, при испарении воды из него соль может выделяться из раствора, кристаллизоваться. Особенно интересно происходит кристаллизация из перенасыщенных растворов некоторых солей.
Приготовьте перенасыщенный раствор тиосульфата натрия Na2S2O3 • 5Н2О. Для этого колбу из 250 г тиосульфата натрия нагрейте на кипящей водяной бане. Через некоторое время все кристаллы исчезнут. Это означает, что соль растворяется в кристаллизационной воде. Если небольшое количество кристаллов не исчезает, добавьте в колбу несколько миллилитров воды.
Закройте колбу ватным тампоном и поставьте не встряхивая охлаждаться. В охлажденную жидкость вставьте стеклянную трубочку, зауженную в нижней части, и опустите кристаллик тиосульфата натрия. Происходит достаточно эффективное явление – вся масса пресыщенного раствора превращается в сплошную кристаллическую массу.
















