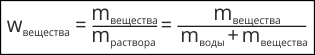При работе с растворами важно знать, сколько растворимого вещества в них содержится. Представьте себе, что могло произойти, если бы фармацевт изготовил глазные капли повышенной концентрации.
Существует несколько способов выражения количественного состава раствора. Чаще всего содержание веществ в растворе выражают в массовых долях.
Массовая доля не имеет размерности и является положительным числом меньше единицы. На практике массовую долю растворенного вещества часто выражают в долях единицы или в процентах:
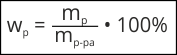
Рассмотрим пример расчетов массовой доли растворенного вещества.
Пример 1. Определить массовую долю купрум (II) хлорида в растворе, содержащем 30 г CuCl2 и 170 г воды.
|
Дано: m(CuCl2) = 30 г |
|
Решение: Воспользуемся приведенной формулой:
|
|
w (CuCl2) – ? |
Ответ: = 15 %.
Это означает, что в 100 г раствора содержится 15 г соли и 85 г воды. На массу соли приходится 15% массы всего раствора.
Пример 2. Испарением 250 г раствора добыли 5 г соли. Какова была массовая доля соли в растворе?
|
Дано: m(р-ра) = 250 г |
Решение:
|
|
|
w(соли) – ? |
Ответ: = 2%.
На практике часто следует приготовить раствор с заданной массовой долей растворенного вещества.
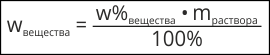 или
или ![]()
Для этого необходимо знать сколько воды и растворенного вещества нужно взять, чтобы получить раствор с заданной массовой долей вещества.
Пример 3. Определить массу купрум (II) хлорида и воды, необходимых для приготовления 300 г раствора с массовой долей соли 0,15 или 15%.
|
Дано: m(р-ра) = 300 г |
mр = w • mр-ра или |
Решение: 1. Сначала вычисляем массу соли, необходимой для приготовления раствора: m(CuCl2) = 0,15 • 300 = 45 г или m(CuCl2) = 2. Вычисляем массу воды: m(H2O) = m раствора – m вещества |
|
m(солі) – ? |
При работе с растворами удобнее брать не массу воды, а ее объем. Для нахождения объема воды необходимо ее массу разделить на плотность.
![]() , де V –объём; m – масса ; ρ – плотность.
, де V –объём; m – масса ; ρ – плотность.
1 л воды = 1000 мл.
ρ(H2O) = 1 г/мл.
Отсюда: ![]() = 255 мл.
= 255 мл.
Ответ: m(CuCl2) = 45 г, m(H2O) = 255 г или 255 мл.
Для того, чтобы приготовить 300 г раствора с массовой долей 15% необходимо взвесить 45 г CuCl2 и поместить ее в колбу. Мензуркой отмерить 255 мл воды и вылить в колбу с солью и перемешивать до тех пор, пока не растворится вся соль.
Итог:
- Массовая доля растворенного вещества в растворе – это отношение массы вещества к массе раствора.
- Раствор состоит из растворимого вещества и растворителя.
?
- Что такое раствор?
- Что такое массовая доля растворимого вещества?
- Что означает: а) 5% раствор соли; б) 20% раствор соли?
- Как приготовить раствор с заданной массовой долей растворимого вещества?
Практическая работа 1. Приготовление раствора соли с определенной массовой долей растворимого вещества
Для работы необходимы:
- реактивы: кристаллическая соль – натрий хлорид;
- оборудование: технохимические весы с грузиками, химический стакан или колба с этикеткой, на которой указана массовая доля растворимого вещества и масса раствора, мерный цилиндр, стеклянная палочка с резиновым наконечником, шпатель или ложечка, фильтровальная бумага, мягкая тряпка.
Завдання:
- Приготовить 10 г раствора с массовой долей натрия хлорида 0,05.
- Приготовить 10 г раствора с массовой долей натрия хлорида 0,02.
Порядок выполнения работы:
- Вспомните, какие правила безопасности следует соблюдать при выполнении работы.
- Вычислите, какую массу соли и воды следует взять для изготовления раствора, указанного в условии задачи.
- Взвесьте на весах соль и поместите ее в колбу.
- Отмерьте мерным цилиндром нужный объем дистиллированной воды и вылейте ее в колбу с солью.
- Перемешайте содержимое стакана или колбы стеклянной палочкой с резиновым наконечником до полного растворения соли.
- Вылейте раствор в подготовленный стакан.