Растворы кислот, щелочей и солей в воде
На рубеже XVIII-XIX веков, для исследования свойств вещества начали применять электрический ток и обратили внимание на то, что одни вещества, находясь в водном растворе, проводят электрический ток, а другие — не проводят. Вещества, которые проводят ток в водном растворе или расплаве, не проводят его в сухом виде.
Если погрузить электроды в сухую поваренную соль, замкнуть электрическую цепь, как показано на рисунке 21, то лампочка не загорится.
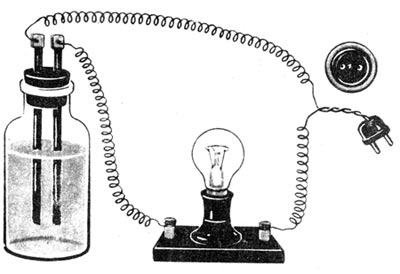
Рис. 21. Прибор для исследования электропроводности растворов
Следовательно, сухая соль электрического тока не проводит. Такой же результат получим, если электроды погрузить в дистиллированную воду. Однако лампочка ярко загорится, если смешать соль с дистиллированной водой и погрузить электроды в водный раствор соли. Электрический ток проводят также водные растворы щелочей и кислот. Раствор сахара в воде электрического тока не проводит.
Почему водные растворы одних веществ проводят электрический ток, а другие — не проводят?
Электрический ток — это направленное движение электронов. Электрическая проводимость растворов электролитов обусловлена наличием в них положительно и отрицательно заряженных ионов, которые образуются из молекул или кристаллов веществ под воздействием воды. У веществ с ионной или ковалентной сильнополярной химической связью под действием полярной молекулы воды такие ионы образуются. Но если эти вещества растворить в других неполярных растворителях (бензин, керосин), ионы не образуются и тока они проводить не будут. В ковалентных неполярных соединениях ионов нет, неполярные молекулы не будут притягивать диполи воды, поэтому раствор, например, сахара тока не проводит.
Следовательно, в водных растворах кислот, солей и щелочей возникают заряженные частицы — ионы, благодаря чему их растворы проводят электрический ток.
Электролиты и неэлектролиты
| Вещества | |
| Электролиты Электролитами называют вещества, водные растворы которых проводят электрический ток. К таким веществам относятся соли, щелочи и кислоты. В этих веществах есть ионная или ковалентная сильнополярная химическая связь. |
Неэлектролиты Неэлектролитами называют вещества, водные растворы которых не проводят электрический ток. К таким веществам относятся, например, кислород, азот, водород, метан, сахар и др. Для этих веществ характерна ковалентная неполярная связь. |
Среди электролитов есть ионные и молекулярные вещества.

М. Фарадей — выдающийся английский ученый физик и химик.
Разделение веществ на электролиты и неэлектролиты впервые предложил английский ученый М. Фарадей, который открыл законы электролиза, ввел основную электрохимическую терминологию. Одним из первых начал изучать реакции, происходящие в присутствии катализаторов.
Следовательно, электролитами могут быть только вещества с ионным и ковалентным полярным типом химической связи. Кроме того, молекулы растворителя также должны быть полярными. Только при таких условиях можно ожидать расщепления молекул или кристаллов вещества на ионы. Нерастворимые в воде соли, основания являются неэлектролитами.
Теория электролитической диссоциации
Ионы — заряженные частицы

С. А. Аррениус
(1859-1927).
Шведский ученый, академик. Лауреат Нобелевской премии.
Для объяснения особенностей водных растворов электролитов шведский ученый С. Аррениус в 1887 году предложил физическую суть теории электролитической диссоциации.
С.А. Аррениус в 1887 г. сформулировал положение об электролитической диссоциации.
Он доказал, что разложение веществ в растворе на ионы происходит и без действия электролитического тока. Позднее его теория была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим положениям:
Катионы — положительно заряженные ионы
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. (Слово «ион» – с греческого означает «странствующий». В растворе ионы беспорядочно перемещаются в разных направлениях).
Анионы — отрицательно заряженные ионы
2. Электролитическая диссоциация — обратимый процесс, – параллельно с расщеплением молекул на ионы происходит процесс соединения ионов.
3. Под действием электрического тока ионы приобретают направленное движение: положительные ионы перемещаются к катоду, поэтому называются катионами, отрицательно заряженные – к аноду, поэтому называются анионами.
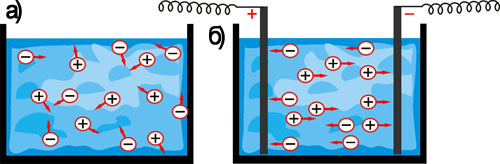
Рис. 22. а) Хаотическое движение ионов в растворах и расплавах.
б) Направленное движение ионов при пропускании постоянного электрического тока через электролит.
4. Ионы отличаются от атомов как строением так и свойствами.
Атом Na ![]() ; Ион Na
; Ион Na ![]() .
.
Например, атомы Натрия образуют простое вещество – металл натрий с четко выраженными металлическими свойствами. Атомы Натрия легко отдают электрон внешнего уровня, поэтому атомы химически активны, при обычных условиях окисляются на воздухе, реагируют с водой и прочее. Ионы Натрия не отдают электронов, поэтому не могут окисляться и с водой не реагируют. Атомы Хлора образуют простое вещество Хлор – ядовитый газ с резким неприятным запахом. Атомы Хлора легко присоединяют электрон, поэтому восстанавливаются. Ионы Хлора электронов не присоединяют. Поваренная соль NaCl образована ионами Na+ и Cl– не ядовита, не имеет запаха, не содержит металлического натрия.
Итог:
- Процесс распада веществ на ионы при их растворении называют электролитической диссоциацией.
- Электролиты проводят электрический ток. Это вещества с ионной или ковалентной полярной связью.
- Неэлектролиты не проводят электрический ток. Это вещества с ковалентной неполярной связью.
- Ионы — это заряженные частицы, в которые превращается атом в результате отдачи или присоединения электронов.
- В растворах электролитов, являющихся молекулярными веществами, происходит два процесса. Первый — распад молекул на ионы (диссоциация), а второй — соединение молекул в ионы (ассоциация).
?
- Объясните, почему раствор поваренной соли проводит электрический ток, а раствор сахара — нет.
Какие вещества относятся к электролитам? Дайте определение.
Какие вещества относятся к неэлектролитам? Дайте определение.
Что называется электролитической диссоциацией?
Чем обусловлена электрическая проводимость растворов электролитов?

















