Диссоциация кислот
Большинство кислот хорошо растворяются в воде. Из известных вам кислот только силикатная кислота в ней не растворяется. Растворы кислот изменяют цвет индикаторов: лакмуса — на красный, метилового оранжевого – на розовый.
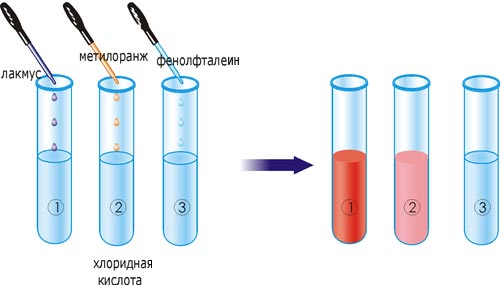
Рис. 24. Изменение цвета индикаторов в растворе хлоридной кислоты
Это свойство кислот используют для распознавания их среди других веществ. Почему растворимые в воде кислоты проявляют такие свойства? Рассмотрим процесс диссоциации кислот. Процесс диссоциации кислот, например, нитратной, сульфатной и фосфатной кислот, следует изобразить так:
HNO3 ⇄ H+ + NO3–.
H2SO4 ⇄ 2H+ + SO42–
H3PO4 ⇄ 3H+ + РO43–
В процессе диссоциации образуются положительные ионы Гидрогена и отрицательные ионы кислотного остатка: нитрат-ион NO3–, сульфат-ион SO42– і фосфат-ион РO43–. Общим для всех кислот является наличие ионов Гидрогена. Именно H+ придает кислотам характерные для них общие химические свойства, изменяет цвет индикаторов. Знак «обратности» (⇄) показывает одновременное протекание двух процессов — прямого (слева направо), т.е. диссоциацию, и обратного (справа налево) – ассоциацию.
Все растворимые кислоты в водных растворах диссоциируют на гидроген-ионы H+ и кислотные остатки.
Процесс диссоциации кислот можно изобразить следующей схемой:
HnR ⇄ nH+ + Rn–, где R – кислотный остаток, n – число атомов Гидрогена.
Многоосновные кислоты диссоциируют ступенчато. Например:
| III HR2– ⇄ H+ + R3–
II HR2– ⇄ H+ + R3– I HR2– ⇄ H+ + R3–
|
H3PO4 ⇄ H+ + H2PO4– дигидрогенфосфат-ион H3PO4– ⇄ H+ + HPO42– гидрогенфосфат-ион H3PO42– ⇄ H+ + PO43– фосфат-ион H3PO4 ⇄ 3H+ + PO43– |
Диссоциация оснований
Растворы оснований (щелочи) изменяют цвет индикаторов: лакмуса — на синий, метилового оранжевого — на желтый, фенолфталеина — на малиновый:
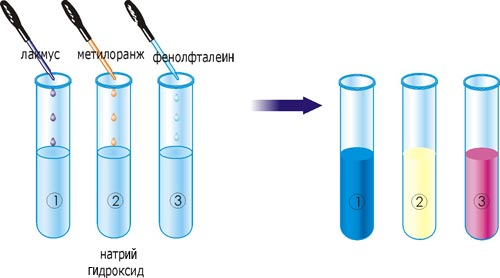
Рис. 25. Изменение цвета индикаторов в растворе щелочи.
Это свойство оснований используют для распознавания их среди других веществ. Почему растворимые в воде основания проявляют такие свойства? Рассмотрим процесс диссоциации натрий гидроксида и калий гидроксида:
NaOH ⇄ Na+ + OH–
КOH ⇄ К+ + OH–
В процессе диссоциации образуются положительные ионы Натрия и Калия и отрицательные гидроксид-ионы. Общим для всех растворимых оснований является наличие гидроксид-ионов. Именно ОН– придает основаниям характерные для них общие химические свойства, изменяет цвет индикаторов. Щелочи диссоциируют на положительно заряженные катионы металлических элементов и отрицательно заряженные гидроксид-ионы.
Процесс диссоциации оснований можно изобразить такой схемой:
MeOH ⇄ Men+ + nOH–, где n – валентность металлического элемента.
Если гидроксид содержит в молекуле несколько групп OH–, то может произойти ступенчатая диссоциация. Например:
Ba(OH)2 ⇄ Ba(OH)+ + OH– (I ступень)
Ba(OH)+⇄ Ba2+ + OH– (II ступень).
Ba(OH)2 ⇄ Ba2+ + 2OH– суммарное уравнение
Сначала отщепляется один гидроксид-ион, а последующие OH– – в сильно разбавленных растворах.
Лабораторный опыт 1. Выявление ионов Гидрогена и гидроксид-ионов в растворе
Опыт 1. Выявление ионов Гидрогена в растворе.
В три пробирки с хлоридной кислотой добавьте по 1-2 капли индикатора: в первую – лакмуса, во вторую – метилового оранжевого, в третью – фенолфталеина. Что наблюдается? Каким индикатором нельзя обнаружить ионы водорода? Какой вывод можно сделать о действии кислот на индикаторы?
Опыт 2. изучение гидроксид-ионов в растворе.
В три пробирки с натрий гидроксидом добавьте по 1-2 капли индикатора: в первую – лакмуса, во вторую – метилового оранжевого, в третью – фенолфталеина. Какой можно сделать общий вывод о действии щелочей на индикаторы? Заполните таблицу:
|
Индикаторы |
Цвет индикатора в среде |
||
|
нейтральной |
кислой |
щелочной |
|
|
лакмус метилоранж фенолфталеин |
|||
Чем обусловлены общие свойства кислот и щелочей?
Диссоциация солей
Различают такие соли: средние, кислые и основные.
Средние соли – продукты полного замещения атомов Гидрогена в молекуле кислоты на ионы металлического элемента. Процесс диссоциации средних солей можно изобразить такой схемой:
MexRy ⇄ xMen+ + yRn–, где х – число атомов металлического элемента, у – число кислотных остатков, n – валентность металлического элемента.
Например: NaCl ⇄ Na+ + Cl–
Al2(SO4)3 ⇄ 2Al3+ + 3SO42–
Средние соли – это электролиты, которые в водных растворах диссоциируют на катионы металлических элементов и анионы кислотных остатков.
Растворы солей не имеют общих свойств, потому что не имеют общих ионов.
Итог:
- Продуктами диссоциации кислот являются катионы Гидрогена и анионы кислотных остатков.
- В растворах солей содержатся катионы металлических элементов, и анионы кислотных остатков.
- В растворах щелочей содержатся катионы металлических элементов, и анионы ОН–.
- Диссоциируют только растворимые в воде соединения. Нерастворимые основания, как Zn(OH)2, Al(OH)3 и другие; кислота – H2SіO3, нерастворимые соли – ZnS, AgCl, BaSO4. Оксиды не диссоциируют.
- Сильные электролиты диссоциируют полностью (одна степень), слабые — ступенчато.
?
- Что такое электролитическая диссоциация?
- Дайте определение кислот, щелочей, солей с точки зрения электролитической диссоциации?
- Чем диссоциация кислых солей отличается от диссоциации средних солей?
- Наличие каких ионов обусловливает кислотные и щелочные свойства растворов?
- Почему растворы солей не имеют общих свойств?
Для тех, кто хочет знать больше
Кислые соли – продукты неполного замещения атомов Гидрогена в молекуле кислоты на ионы металлического элемента.
Процесс диссоциации кислых солей можно изобразить такой схемой:
MeHR ⇄ Men+ + HRn–; HRn– ⇄ H+ + Rn–
Диссоциация кислых солей происходит ступенчато. Например:
а) диссоциация калий гидрогенсульфата:
KHSO4 ⇄ K+ + HSO4– (I ступень)
HSO4– ⇄ H+ + SO42– (II ступень)
б) диссоциация кальций дигидрогенфосфата:
Ca(H2PO4)2 ⇄ Ca2+ + 2H2PO4– (I ступень)
H2PO4– ⇄ H+ + HPO42– (II ступень)
HPO42– ⇄ H+ + PO43– (III ступень)
Диссоциация на II и III ступенях очень мала, поэтому раствор кислой соли содержит лишь незначительное количество гидроген-ионов.
Основные соли – продукты неполного замещения гидроксид-ионов в молекулах многоосновных гидроксидов на анионы кислотных остатков.
Заряд катиона равен сумме зарядов аниона с противоположным знаком.
Процесс диссоциации основных солей можно изобразить такой схемой:
MeOHR ⇄ MeOHn+ + Rn–
Например:
магний гидроксихлорид MgOHCl ⇄ MgOH+ + Cl–
ферум дигидроксихлорид Fe(OH)2Cl ⇄ Fe(OH)2+ + Cl–
алюминий гидроксихлорид Al(OH)Cl2 ⇄ AlOH2+ + 2Cl–
Диссоциация катиона на ион металлического элемента и OH– почти не происходит.


















